Les interactions protéine-protéine jouent un rôle fondamental dans les voies de signalisation qui régulent l'homéostasie cellulaire. Elles constituent un réseau dynamique, l'interactome capable d'intégrer des signaux tant intra qu'extra-cellulaires. Les propriétés structurales et fonctionnelles de ces interactions et leur dérégulation dans de nombreuses pathologies offrent des opportunités pour des interventions thérapeutiques.
 La protéine-kinase CK2 est un complexe protéique formé de l'association de deux sous-unités catalytique (CK2α) avec deux sous-unités régulatrices (CK2ß). Des études cristallographiques et des techniques d'imagerie de fluorescence ont permis d'établir que la formation de ce complexe dans la cellule est un phénomène dynamique dont l'importance fonctionnelle doit être évaluée. En effet, le déséquilibre dans l'expression des sous-unités de CK2 fréquemment observé dans différentes pathologies cancéreuses souligne la flexibilité de leur interaction. La possibilité d'interférer avec les interactions sur lesquelles repose la formation du complexe CK2 devrait fournir un moyen d'exercer un contrôle unique sur les événements cellulaires majeurs régulés par cette enzyme.
La protéine-kinase CK2 est un complexe protéique formé de l'association de deux sous-unités catalytique (CK2α) avec deux sous-unités régulatrices (CK2ß). Des études cristallographiques et des techniques d'imagerie de fluorescence ont permis d'établir que la formation de ce complexe dans la cellule est un phénomène dynamique dont l'importance fonctionnelle doit être évaluée. En effet, le déséquilibre dans l'expression des sous-unités de CK2 fréquemment observé dans différentes pathologies cancéreuses souligne la flexibilité de leur interaction. La possibilité d'interférer avec les interactions sur lesquelles repose la formation du complexe CK2 devrait fournir un moyen d'exercer un contrôle unique sur les événements cellulaires majeurs régulés par cette enzyme.
Dans cette étude, nous apportons la preuve que l'organisation multimérique de CK2 est réversible
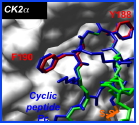
in vitro. Par une combinaison d'analyses cristallographiques et de mutagenèse dirigée, nous montrons qu'un nombre limité d'acides aminés hydrophobes de CK2ß localisés à l'interface dominent l'affinité et représentent des « hot spots » pour l'interaction. En particulier, les résidus Tyr188 et Phe190 représentent des éléments structuraux déterminant d'une boucle de CK2ß qui s'engage dans une poche hydrophobe présente sur CK2α (Figure). Ces résultats ont permis de concevoir de façon rationnelle des petits peptides inhibiteurs de l'interaction. Un peptide contraint de 11 acides aminés s'est révélé particulièrement actif pour 1) antagoniser l'association entre les deux sous-unités , 2) dissocier le complexe de CK2 et 3) affecter sa spécificité de substrat.
Ce peptide représente le premier antagoniste qui se fixe sur l'interface entre les sous-unités de CK2 en inhibant leur interaction. La conformation de ce peptide sert à présent de support pour la synthèse rationnelle de molécules chimiques capable de bloquer cette interaction.