Les cancers du rein sont notoirement connus pour leur résistance aux traitements radio/chimio-thérapeutiques ainsi qu’aux thérapies ciblant leur intense néo-vascularisation. Cette formation de nouveaux vaisseaux sanguins fonctionnels, ou angiogenèse, est souvent à l'origine des résistances aux traitements dans la mesure où elle permet l’irrigation et les apports en nutriments nécessaires à la croissance de la tumeur. De nombreux cancers ont leur origine dans l’activation aberrante de voies de signalisation intracellulaires dans lesquelles les protéine-kinases jouent des rôles essentiels. La recherche de nouvelles cibles thérapeutiques ciblant ces enzymes peut constituer une voie privilégiée dans le cadre des thérapies ciblées, d’où l’idée de perturber l’activité de certaines d'entre elles.
Les chercheurs de notre laboratoire se proposent d'identifier de nouvelles cibles candidates pour le traitement du carcinome rénal à cellules claires métastatique (mccRCC), huitième cancer le plus répandu au monde et représentant 4 % de tous les cancers. En se basant sur le principe de
létalité synthétique, ils ont évalué par un
criblage chemogénomique les effets de plus de 8 000 combinaisons d'inhibiteurs de protéine-kinases sur la viabilité d’une lignée cellulaire représentative du cancer du rein métastatique. Le criblage effectué sur la plate-forme de criblage pour des molécules bio-actives du laboratoire a permis de sélectionner l’une de ces combinaisons ciblant deux protéines kinases importantes dans les mécanismes de survie cellulaire et de réparation de l’ADN : les protéine-kinases CK2 et ATM. La protéine-kinase CK2 est une vieille connaissance de ces chercheurs. Depuis plusieurs années, ils ont montré que cet enzyme est impliqué dans la plasticité cellulaire, dans la réponse au stress, dans la prolifération cellulaire et ont démontré de façon non ambiguë qu’elle était impliquée dans de nombreux cancers (rein, prostate, sein, choliocarcinome…). Par ailleurs, ils développent une approche innovante pour l’inhiber à l'aide de petites molécules chimiques. La protéine-kinase ATM, quant à elle, est activée à la suite d'une cassure double-brin de l’ADN.
Au cours de leur étude, les chercheurs ont découvert que l’inhibition simultanée des kinases CK2 et ATM par des petites molécules chimiques dans les cellules tumorales rénales ainsi que dans les échantillons de tumeurs prélevés sur les patients, induit une létalité synthétique. Point important, cette inhibition simultanée épargne les cellules normales. Leurs études mécanistiques réalisées sur des cellules rénales cancéreuses cultivées sous la forme de sphéroïdes (culture 3D) ont révélé que cette double inhibition provoque une production excessive de radicaux libres intracellulaires conduisant à une mort cellulaire massive par apoptose.
Ces résultats mettent en évidence l’intérêt d’une thérapie combinant l’inhibition simultanée des protéine-kinases CK2 et ATM pour traiter les formes résistantes/agressives de cancer du rein.
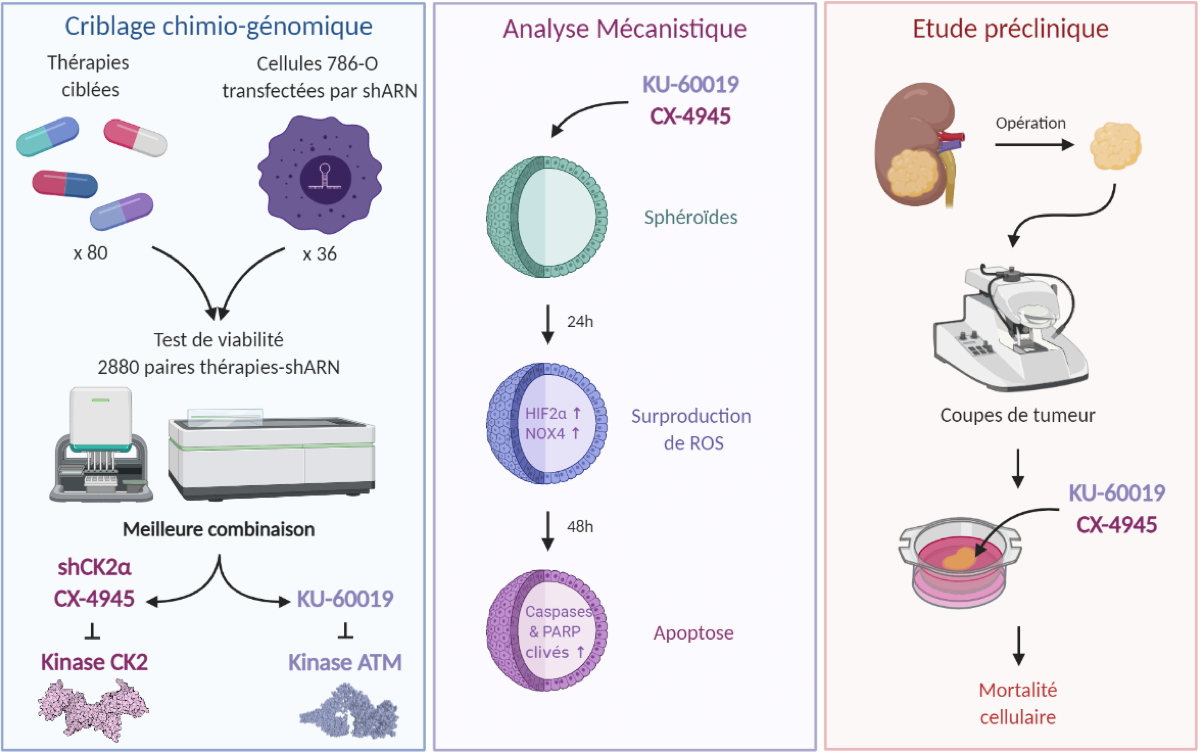
A. Le criblage chemogénomique : 80 petites molécules chimiques ciblant des protéine-kinases, testées sur 36 lignées de cellules cancéreuses rénales 786-O, chacune exprimant un ARN interférant (shRNA) pour diminuer l’expression d’un gène particulier, ont permis d’identifier un couple inhibiteur-shRNA (KU-60019-shCK2α) particulièrement efficace pour affecter la viabilité cellulaire. Ce couple cible respectivement les protéine-kinases ATM et CK2. Dans la suite du travail, le shARN dirigé contre CK2α a été remplacé par une molécule chimique, CX-4945, inhibant spécifiquement cette enzyme.
B. L’analyse du mécanisme d’action de la combinaison (KU-60019 et CX-4945) réalisée à l’aide de sphéroïdes (culture cellulaire en 3 dimensions) montre que ces molécules inhibitrices induisent
via les protéines HIF-2α et NOX4, une production excessive de réactifs de l’oxygène (ROS) entraînant une mort cellulaire massive.
C. Testée sur des prélèvements de tumeurs de rein humain (étude préclinique COMBOREIN), cette combinaison d’inhibiteurs montre son efficacité pour induire la mort des cellules cancéreuses.
Létalité synthétique : mort cellulaire résultant de la déficience de deux ou plusieurs gènes/protéines.
Le
criblage chemogénomique vise à identifier parmi des molécules chimiques inhibant des protéines et/ou des ARN interférants diminuant leur expression, des cibles dont l’inactivation induit un phénotype cellulaire intéressant.