L'angiogenèse consiste en la formation de nouveaux vaisseaux sanguins à partir d’un réseau sanguin existant. Elle est quiescente chez l’adulte sauf chez la femme au cours du cycle menstruel ou lors de la cicatrisation. Cette quiescence est due à un équilibre entre facteurs circulants pro-angiogéniques (VEGF : Vascular Endothelial Growth Factor) et anti-angiogéniques. L'angiogenèse est réactivée dans certaines pathologies et la quasi-totalité des cancers. La compréhension des mécanismes moléculaires régulant l’angiogenèse et l’identification de molécules-clés impliquées dans ce processus devrait permettre d’identifier de nouvelles cibles thérapeutiques pour combattre et contrôler l’angiogenèse et par voie de conséquence le cancer.
ALK1 (
Activin Receptor-like Kinase 1) est un récepteur de la famille TGFß dont les mutations sont responsables d’une maladie vasculaire, la maladie de Rendu-Osler de type 2, encore appelée Télangiectasie Hémorragique Héréditaire (HHT2) (
Figure 1). Cette pathologie génétique se caractérise par des saignements de nez spontanés (épistaxis) et des jonctions directes artères/veines (fistules artério-veineuses hépatiques, pulmonaires et cérébrales). Des mutations d’un autre récepteur de cette famille, l’endogline, sont responsables de la forme HHT1.
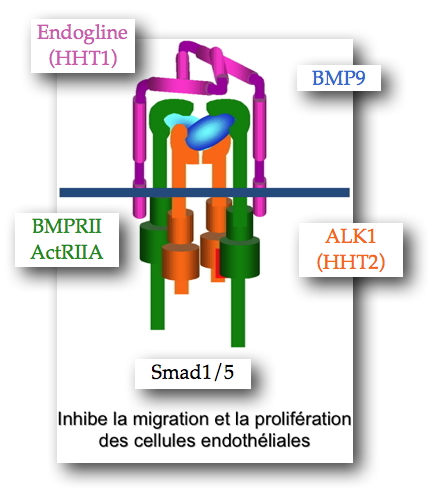
Figure 1 : Voie de signalisation BMP9/ALK1. Implication dans la maladie de Rendu-Osler (HHT).
BMP9 est le ligand du récepteur ALK1, exprimé spécifiquement à la surface des cellules endothéliales. Le dimère de BMP9 se lie à un hétérotétramère constitué de deux récepteurs de type 1 (ALK1) et de deux récepteurs de type 2 (BMPRII ou ActRIIA). La présence du récepteur de type 3, endogline, également sous forme de dimère, augmente la réponse de ce complexe. L’activation de cette voie entraîne le recrutement et la phosphorylation des facteurs de transcription Smad1 ou Smad 5, puis leur translocation au noyau. L’addition de BMP9 entraîne l’inhibition de la prolifération et de la migration des cellules endothéliales et donc la quiescence des vaisseaux sanguins.
Notre objectif est de comprendre le rôle de la signalisation des récepteurs de la famille TGFß, et plus particulièrement du complexe BMP9/ALK1 dans l'angiogenèse et la lymphangiogenèse afin de proposer de nouvelles approches thérapeutiques ciblées dans les pathologies vasculaires et le cancer. En 2007, nous identifions BMP9 (
Bone Morphogenetic Protein 9) comme le ligand du récepteur ALK1
[1]. L’année suivante, nous démontrions la présence de BMP9 dans le sang à des concentrations biologiquement actives ainsi que l’implication de BMP9 circulant dans la quiescence des vaisseaux sanguins
[2]. Aujourd’hui nous montrons que BMP9 est produit principalement par le foie (
Figure 2), et plus particulièrement par les hépatocytes et les cellules épithéliales des canaux biliaires
[3]. Ils établissent également que BMP9 circule sous une forme inactive et une forme active, et que cette dernière maintient les cellules endothéliales sous une forme quiescente en activant en permanence la voie de transduction du signal impliquant la phosphorylation des facteurs de transcription Smad1 ou Smad5.
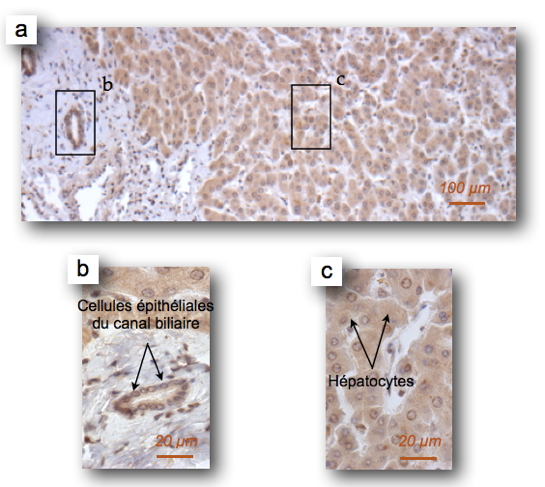
Figure 2 : Immuno-histochimie d’une coupe de foie humain révélée avec un anticorps (marquage brun) dirigé contre BMP9.
Ce travail met en évidence les sites d’expression de BMP9 et caractérise ses formes circulantes. Ces découvertes pourraient expliquer pourquoi le foie est l’organe le plus touché dans la maladie de Rendu-Osler de type 2.