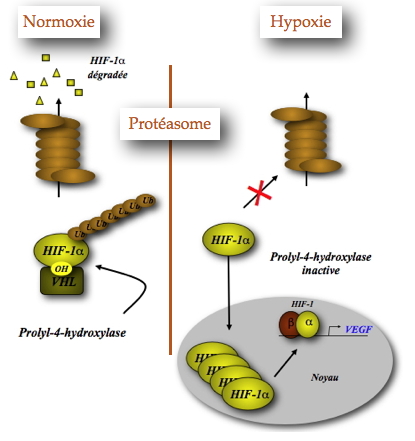
Les espèces animales sont dotées d’un système d’adaptation à de fortes baisses de la concentration d’oxygène. La survenue d’un stress hypoxique entraîne la stabilisation et l’activation de la sous-unité α du facteur de transcription induit par l’hypoxie, HIF-1 (Hypoxia inducible factor 1). HIF-1 coordonne l’induction de l’expression de plusieurs gènes qui contribuent à compenser le manque d’oxygène (gènes de l’angiogenèse, de l’érythropoïèse, de la glycolyse anaérobie, de la survie cellulaire…).
L'hypoxie observée au centre des tumeurs en prolifération rapide est un inducteur majeur de l'angiogenèse tumorale. Cet effet est causé par l'induction transcriptionnelle du gène majeur de l'angiogenèse, VEGF, par le facteur HIF-1. L'étude de la régulation d'HIF-1 par l'hypoxie peut donc contribuer à une meilleure connaissance des mécanismes de l'angiogenèse tumorale et à des applications thérapeutiques pour le traitement des cancers.
À ce jour, le seul mécanisme de régulation de l'expression de HIF-1 par l'hypoxie (
Figure 1) se situe au niveau de la protéine HIF-1α. Cependant, un second niveau de régulation existe au niveau de son ARNm et a été négligé jusqu'à présent.
Nous avons analysé les variations des taux d'ARNm et de protéine HIF-1α en réponse à un traitement hypoxique de cellules endothéliales micro-vasculaires
[1]. La réponse initiale de ces cellules à l’hypoxie (0 à 3 heures) se traduit par une augmentation de la protéine HIF-1α alors que son taux d’ARNm reste inchangé. En revanche, l’hypoxie prolongée (plus de 3 heures) diminue progressivement les taux d’ARNm et de protéine HIF-1α (
Figure 2). La
région 3’ non traduite de l’ARNm de HIF-1α contient de multiples éléments riches en adénines et uridines qui sont des cibles potentielles de protéines stabilisatrices ou déstabilisatrices des ARNm. Notre objectif a été d’identifier les mécanismes impliqués dans la décroissance de l’ARNm de HIF-1α dans les cellules endothéliales soumises à l’hypoxie. Le rôle des facteurs déstabilisateurs des ARNm de la famille Tristétraproline (TTP, Tis11b et Tis11d) dans la régulation négative d'ARNm HIF-1α a donc été étudié.
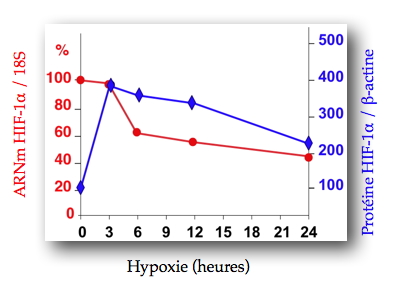 Figure 2 : Influence de l'hypoxie sur les taux d'ARN messager HIF-1α (en rouge) et de la protéine HIF-1α (en bleu).
Figure 2 : Influence de l'hypoxie sur les taux d'ARN messager HIF-1α (en rouge) et de la protéine HIF-1α (en bleu).
Les résultats obtenus
[1] montrent que la déplétion de la protéine TTP, dans les cellules endothéliales soumises à l’hypoxie, abolit la diminution du taux d’ARNm de HIF-1α et s’accompagne d’une augmentation de sa demi-vie. Ces observations suggèrent que la diminution de cet ARNm en réponse à l’hypoxie est liée à sa déstabilisation par la protéine TTP. Une interaction directe entre TTP et la région 3’-non traduite de l’ARNm HIF-1α a ensuite été démontrée. Enfin, la déplétion de TTP dans les cellules endothéliales exacerbe l’induction de la protéine HIF-1α par l’hypoxie et s’accompagne d’une augmentation de l’expression d’une enzyme cible majeure de HIF-1α, impliquée dans le contrôle du pH intracellulaire, l’anhydrase carbonique IX.
Ces résultats
[1] indiquent que TTP exerce un rétrocontrôle négatif sur l’expression de HIF-1α en réponse à l’hypoxie et contribue ainsi à la régulation des gènes cibles de ce facteur de transcription. Ainsi, outre le rôle majeur de TTP dans la déstabilisation des ARNm des gènes de l’inflammation, cette protéine jouerait également un rôle clé dans le contrôle de la réponse adaptative des cellules à l’hypoxie. Par ailleurs, une expression effondrée de TTP a été rapportée dans la plupart des cancers humains, indiquant une dérégulation des mécanismes de déstabilisation des ARNm. Ce mécanisme pourrait être à l’origine de la surexpression de l’ARNm de HIF-1α dans les tumeurs malignes humaines.
Les mécanismes de régulation de la stabilité/dégradation des ARNm à demi-vie courte comme ceux de nombreuses cytokines pro-angiogéniques et pro-inflammatoires peuvent être exploités en vue d'une thérapie anti-cancéreuse. Nous avons ainsi fait récemment la preuve de concept de cette nouvelle stratégie en démontrant l'action anti-angiogénique et anti-tumorale d'une protéine TIS11b rendue perméante aux membranes plasmiques
[2].
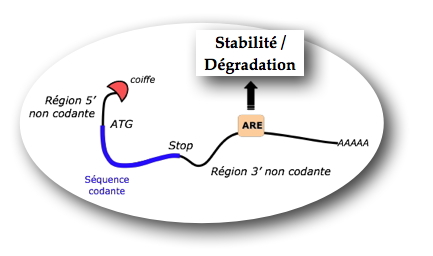
L'ARN messager est un polymère de ribonucléotides qui sert d'intermédiaire entre les gènes et les protéines. On distingue trois principales régions fonctionnelles dans un ARNm : la région 5' non traduite, la région codante pour une protéine et enfin la région 3' non traduite. Les régions 5' et 3' contiennent souvent des signaux d'expression, de maturation ou de régulation de l'ARN. Ici la région ARE (riche en A et U) contrôle la stabilité de l'ARNm de HIF-1α.