Des chercheurs du laboratoire viennent d’identifier le ligand physiologique du récepteur endothélial ALK1 : BMP9
[1]. Ces chercheurs montrent que BMP9 est un nouveau régulateur de l’angiogenèse et qu’il est présent dans le sang à des concentrations biologiquement actives. L’ensemble de ce travail décrit un nouvel acteur de l’angiogenèse BMP9 qui pourrait être un nouveau biomarqueur de l’angiogenèse.
ALK1, (activin receptor-like kinase 1), est un des 7 récepteurs de type 1 de la famille des récepteurs du TGFß. ALK1 est un récepteur orphelin, spécifiquement exprimé à la surface des cellules endothéliales. Des mutations d’ALK1 sont responsables d’une pathologie vasculaire rare, la maladie de Rendu-Osler encore appelée télangiectasie hémorragique héréditaire (HHT), qui se caractérise par des épistaxis récidivantes, des télangiectasies cutanéo-muqueuses et des malformations artério-veineuses. De plus, son invalidation chez la souris entraîne une létalité embryonnaire due à des défauts vasculaires. L’ensemble de ces données démontrait un rôle important d’ALK-1 dans l’angiogenèse, mais son rôle
in vitro au niveau de la cellule endothéliale n’était absolument pas connu.
Ne disposant pas du ligand, ces chercheurs ont démontré en 2002 qu’une forme constitutivement active d’ALK1 inhibait la prolifération et la migration des cellules endothéliales
[2].
Cette année, ils rapportent que deux BMP (Bone Morphogenetic Protein), BMP9 et BMP10, sont capables de se lier et d’activer de manière physiologique, spécifique et à très faible concentration (2 pM) le récepteur ALK1
[1]. Ils proposent un modèle où, suite à la liaison de BMP9 ou BMP10, les récepteurs de type 2, BMPRII ou activine-RIIA sont recrutés, ce qui entraîne le recrutement et la phosphorylation des facteurs de transcription, Smad1, 5, 8. Le récepteur de type III, endogline, est également présent dans ce complexe et sa présence augmente la réponse de BMP9 et BMP10. Enfin, ces chercheurs montrent pour la première fois que BMP9 et BMP10 inhibent la migration et la prolifération des cellules endothéliales. Le rôle inhibiteur de BMP9 dans l’angiogenèse a été confirmé
in vivo par ce même groupe dans deux modèles (éponge chez la souris ; membrane chorioallantoïdienne du poulet).
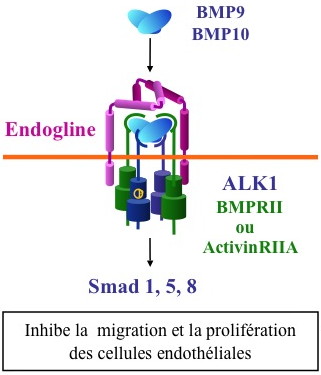
Modèle de transduction du signal d’ALK1
BMP9 et BMP10 sont les nouveaux ligands du récepteur de type 1 ALK1, exprimé spécifiquement à la surface des cellules endothéliales. Ce complexe transductionel est constitué d’un dimère de BMP9 ou 10 qui se lie à un hétérotétramère constitué de deux récepteurs de type 1 (ALK1) et de deux récepteurs de type 2 (BMPRII ou ActivinRIIA). La présence du récepteur de type III, endogline, également sous forme de dimère, augmente la réponse de ce complexe transductionel. L’activation de cette voie entraîne le recrutement et la phosphorylation des facteurs de transcription Smad1, 5, 8. L’addition de BMP9 ou BMP10 entraîne l’inhibition de la prolifération et de la migration des cellules endothéliales.
Enfin, dans ce travail, les chercheurs montrent également que BMP9 est présent dans le sang à des concentrations biologiquement actives. Ce travail identifie BMP9 comme un nouvel acteur de l’angiogenèse. Il ouvre un tout nouveau champ d’investigation concernant l’implication des BMPs dans l’angiogenèse. BMP9 pourrait être marqueur de l’état d’activation de l’endothélium. Il pourrait s’avérer particulièrement intéressant comme marqueur de substitution (« surrogate ») dans le développement et le suivi des traitements anti-angiogéniques.