La pathologie vasculaire Télangiectasie Hémorragique Héréditaire, plus communément appelée maladie de Rendu-Osler, provoque des saignements de nez, et des malformations artérioveineuses des poumons, du foie, ou du système nerveux central. Cette maladie génétique rare est due à des mutations de plusieurs gènes, dont le gène « Activin receptor-Like Kinase 1 » (ALK1) qui code pour un récepteur à activité kinase exprimé à la surface des cellules endothéliales tapissant les vaisseaux sanguins. Une équipe de notre laboratoire cherche à mieux comprendre les mécanismes moléculaires à l’origine de la maladie de Rendu-Osler en étudiant les voies de signalisation au sein des cellules endothéliales.
En 2007, l'équipe a identifié deux protéines « Bone Morphogenetic Protein » (BMP9 et BMP10) comme ligands du récepteur ALK1 [
1,2]. La liaison de ces deux protéines sur ce récepteur entraine la
phosphorylation de facteurs de transcription de l’ADN, dont la fonction est de réguler l’expression des gènes. L’objectif de ce travail a été d’identifier de nouvelles voies de signalisation activées par ces facteurs en stimulant des cellules endothéliales humaines. Pour la première fois, une étude à large échelle en collaboration avec d'autres équipes [
Collaboration] a permis de comparer quantitativement les abondances relatives de plus de 10 000 sites de phosphorylations. Cette analyse phospho-protéomique, basée sur la spectrométrie de masse, a permis d’identifier de nouvelles voies de signalisation en réponse à une stimulation par les protéines BMP9 et BMP10. Notamment la voie de signalisation MAPK (mitogen activated protein kinases) [
3].
La finalité de ces recherches est de proposer de nouvelles voies thérapeutiques pour la maladie de Rendu-Osler.
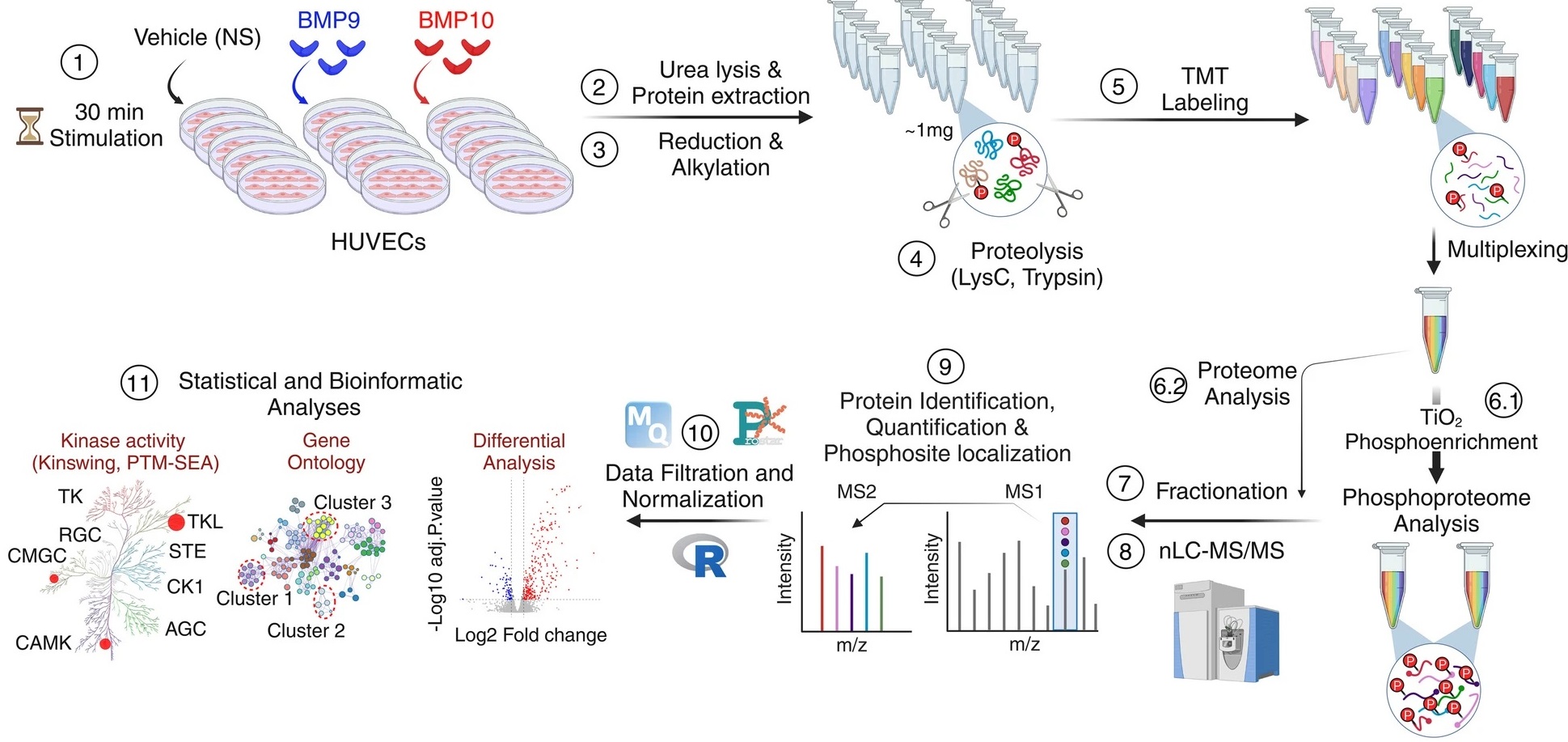
Figure : Des cellules endothéliales sont stimulées avec les protéines BMP9 ou BMP10 puis traitées pour être analysées par une approche phospho-protéomique basée sur la spectrométrie de masse suivie par des analyses bioinformatiques afin d’identifier les protéines différemment phosphorylées et caractériser les de nouvelles voies de signalisation.
(1) Les cellules endothéliales humaines de cordon ombilicaux (HUVEC) ont été stimulées ou non (NS) avec 10 ng/mL de BMP9 ou BMP10 pendant 30 min.
(2) Des lysats de cinq réplicats biologiques par condition ont été préparés et
(3) soumis à une réduction et une alkylation, suivies d'une
(4) digestion en utilisant une combinaison de deux endoprotéinases, LysC et trypsine.
(5) Les peptides résultants ont été marqués avec des réactifs de marquage de masse en tandem (TMT) et regroupés pour l’analyse.
(6.1) Les peptides phosphorylés ont ensuite été enrichis à l'aide de billes de dioxyde de titane (TiO2)
(6.2) tandis qu'une petite partie des échantillons regroupés a été réservée à l'analyse protéomique
(7-8) Les échantillons de protéome et de phospho-protéome ont été fractionnés et analysés par chromatographie liquide et spectrométrie de masse en tandem (LC–MS/MS).
(9–11) L’analyse des données a ensuite été réalisée à l’aide de différents outils bioinformatiques.
Credit CEA.
La phosphorylation est l’addition d’un groupe phosphate à une protéine ou une petite molécule comme par exemple par une protéine kinase.
La spectrométrie de masse est une technique d’analyse qui permet la détermination de la masse moléculaire ainsi que l’identification de complexes moléculaires.
Collaboration
BAL (Irig/Biosanté) EDyP (Irig/BGE) et IMAC (Irig/Biosanté)