L’angiogenèse est la formation de nouveaux vaisseaux sanguins à partir d’un réseau sanguin existant. Elle est quiescente chez l’adulte sauf chez la femme au cours du cycle menstruel ou lors de la cicatrisation. Cette quiescence est due à un équilibre entre facteurs circulants pro-angiogéniques (VEGF : Vascular Endothelial Growth Factor) et anti-angiogéniques. Cette angiogenèse est réactivée dans des pathologies comme la dégénérescence maculaire liée à l’âge (pathologie de l’œil) et la quasi-totalité des cancers. La compréhension des mécanismes moléculaires régulant l’angiogenèse et l’identification de molécules-clés impliquées dans ce processus pourraient permettre d’identifier de nouvelles cibles thérapeutiques pour combattre et contrôler l’angiogenèse et par voie de conséquence le cancer.
En 2007, nous avons identifié BMP9 et BMP10 comme les ligands physiologiques et spécifiques du récepteur ALK1
[3]. Dans la continuité de ce travail, ce groupe publie cette année, que BMP9 est un régulateur circulant de la quiescence de l’endothélium
[3].
ALK1, pour activin receptor-like kinase 1, est un des 7 récepteurs de type 1 de la famille des récepteurs du TGFß, spécifiquement exprimé à la surface des cellules endothéliales. Des mutations d’ALK1 sont responsables d’une pathologie vasculaire rare, la maladie de Rendu-Osler encore appelée télangiectasie hémorragique héréditaire (HHT), qui se caractérise par des épistaxis récidivantes (saignements de nez), des télangiectasies cutanéo-muqueuses (lac sanguin) et des malformations artério-veineuses. L’identification de BMP9 comme ligand spécifique et physiologique d’ALK1 dans les cellules endothéliales est une avancée majeure dans la compréhension des mécanismes moléculaires de cette pathologie
[3]. Elle permet de proposer un modèle de travail qui place HHT comme une maladie de la voie BMP et non plus de la voie du TGFß
[1].
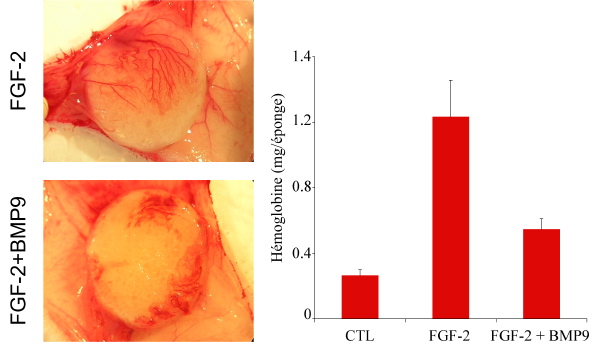
Figure 1 : BMP9 inhibe la néo-angiogenèse chez la souris.
Des souris Bal-C reçoivent en sous-cutanée une éponge en cellulose imbibée de FGF-2 (200 ng) avec ou sans BMP9 (20 ng). FGF-2 et/ou BMP9 sont à nouveau injectés dans l’éponge à jour 1 et 2 et une dernière injection de BMP9 est réalisée à J4. À J7 les éponges sont prises en photo. La quantité d’hémoglobine par éponge est déterminée avec le réactif de Drabkin’s.
Cette année, noous montrons la présence de BMP9 dans le sérum et le plasma. La concentration moyenne de BMP9, déterminée par un système de gène rapporteur utilisant un promoteur sensible aux BMP est de l’ordre de 5 ng/ml, soit supérieure à l’EC50 (45 pg/ml) de l’activation de la voie Smad1/5
[3]. De plus, nous montrons que l’addition de BMP9
in vivo inhibe la néo-angiogenèse chez la souris (modèle d’implantation sous-cutanée d’éponge imbibée de FGF2) (Figure 1) et la circulation sanguine de la membrane chorioallantoïdienne du poulet (Figure 2). Ces résultats permettent de proposer BMP9 comme un facteur clé de la quiescence de l’endothélium, circulant en concentrations actives dans le sang. Ce travail est sous presse dans
Circulation Research[2].
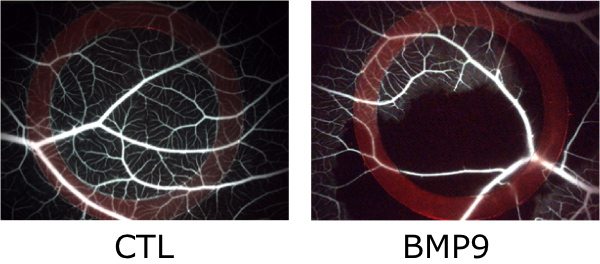
Figure 2 : BMP9 arrête la circulation sanguine de la membrane chorioallantoïdienne (CAM) de l’embryon de poulet.
BMP9 (27,5 ng) ou du PBS sont injectés dans un anneau de silicone placé sur la CAM d’embryons de poulet de 9 jours. 24h après le traitement, du Dextran-FITC est injecté dans les vaisseaux de la CAM et des photos sont prises.
Ce travail ouvre un tout nouveau champ d’investigation concernant l’implication des BMPs dans l’angiogenèse Et suggère que BMP9 pourrait être un outil important dans les approches thérapeutiques de la maladie HHT mais également dans les pathologies où l’angiogenèse est impliquée comme le cancer.