La protéine kinase CK2 joue un rôle déterminant pour le contrôle de la survie cellulaire. Plus précisément, les données structurales
[Référence] ainsi que de nombreux résultats d'études cellulaires
[Référence]
montrent que la sous unité régulatrice de la kinase participe à la régulation de nombreux processus cellulaires tels que l'homéostasie entre prolifération et mort cellulaire. CK2 est donc une cible thérapeutique potentielle
[Référence].
Dans le cadre de thérapies anti prolifératives, nous avons développé un criblage génétique de peptides aptamères visant à identifier des interactants de la sous-unité régulatrice ß de cette protéine kinase. L'un de ces peptides nommé P1, se lie avec une haute affinité avec CK2ß et possède une certaine homologie de séquence avec la protéine IE2 de cytomégalovirus. Après une caractérisation biochimique de cette interaction, l'activité biologique du peptide fusionné à GFP a été examinée dans différents types cellulaires.
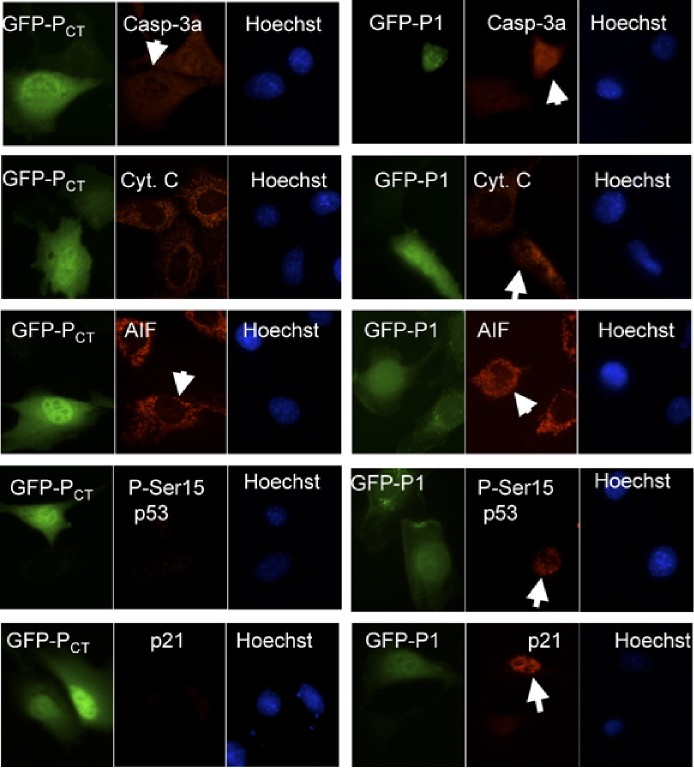
Effets biologiques du peptide P1.
Des cellules NIH3T3 ont été transfectées par des plasmides codant pour GFP-P1 ou GFPCT. Les cellules ont été fixées et perméabilisées après 24 heures de culture puis colorées avec des anticorps reconnaissant la forme active de la Caspase 3 (Casp. 3a), le cytochrome C (Cyt. C), AIF, la Ser 15 phosphorylée de p53 (P-Ser15 p53) ou p21. L'ADN est visualisée par une coloration au Hoeschst 33342.
Les flèches blanches indiquent les cellules transfectées.
Ce peptide entraîne une mort cellulaire qui s'accompagne d'une activation des caspases et de la protéine p53 (figure).
Ces résultats ouvrent des perspectives prometteuses quant à l'exploitation de cette séquence peptidique dans le but de développer de nouveaux agents apoptogènes ciblant CK2ß.