L'angiogenèse est le processus de formation de nouveaux capillaires sanguins à partir de vaisseaux pré-existants. Ce processus, qui est actif au cours du développement embryonnaire, est mis en sommeil au cours de la vie adulte mais est réactivé dans diverses situations pathologiques (cicatrisation, croissance tumorale, etc). La formation de néo-vaisseaux est un processus multi-étapes qui comprend une phase de construction et une phase de maturation. Le facteur de croissance des cellules endothéliales vasculaires VEGF et ses récepteurs sont fortement impliqués dans la phase de construction. La caractérisation des mécanismes de régulation de l'expression du VEGF est indispensable pour la mise en place de stratégies efficaces visant l'angiogenèse pathologique.
L’importance du VEGF (
Vascular Endothelial Growth Factor) dans le contrôle du remodelage vasculaire tumoral a suscité le développement de stratégies thérapeutiques visant à inhiber l’angiogenèse par des anticorps neutralisants anti-VEGF ou des inhibiteurs de l’activité tyrosine kinase des récepteurs du VEGF. Ces molécules associées à une chimiothérapie améliorent la survie globale des patients atteints de formes métastatiques de cancers colorectaux, de cancers du rein, du poumon et du sein. Cependant, leur efficacité est encore insuffisante, les effets secondaires sont multiples et des phénomènes de résistance inattendus, liés à des mécanismes compensatoires, apparaissent au cours des traitements. Par conséquent, bloquer plus efficacement l’angiogenèse et la croissance tumorale en seconde ligne thérapeutique en développant des stratégies anti-VEGF alternatives répond à un besoin médical évident.
Les chercheurs du laboratoir ont été les premiers à montrer que la protéine TIS11b inhibe l’expression du VEGF
[1] en induisant la dégradation de son ARN messager. L’étude des mécanismes moléculaires de l’activité de cette protéine a permis à ces chercheurs d’émettre l’hypothèse que TIS11b pourrait représenter un nouvel agent anti-angiogène et anti-tumoral. Leur stratégie
[2] a consisté à développer une protéine TIS11b capable de traverser les membranes cellulaires, de l’injecter dans des tumeurs préétablies et de suivre la croissance de ces tumeurs (
Figure A). Une inhibition de la croissance tumorale ainsi qu’une réduction spectaculaire de la densité micro-vasculaire tumorale (
Figure B), associées à une diminution du niveau d’expression du VEGF et de plusieurs cytokines pro-inflammatoires et/ou pro-angiogènes (TNFα, IL-6, IL-1, G-CSF, FGF, EGF) ont été observées.
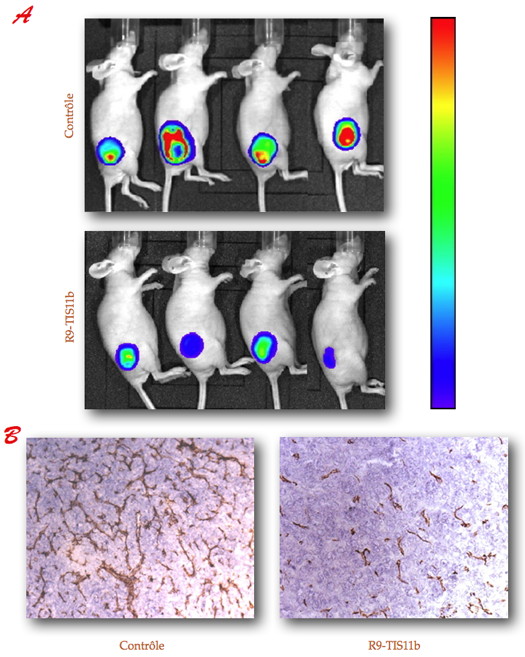
TIS11b a été étiquetée avec une polyarginine (R9) puis injectée dans des tumeurs murines (LLC, Lewis Lung Carcinoma) sous-cutanées chez la souris immunodéficiente (nude).
A - Les souris porteuses de tumeurs traitées (R9-TIS11b) ou non (Contrôle) ont été imagées à l’aide du système IVIS (Calipers) afin de visualiser les cellules tumorales vivantes par bioluminescence. Échelle bleu-rouge : quantité croissante de cellules tumorales bioluminescentes.
B - Effet de R9-TIS11b sur la densité des micro-vaisseaux tumoraux (marron) analysés par immuno-histochimie anti-PECAM.
Ainsi est faite la preuve de concept d’une stratégie anti-cancéreuse multi-cibles novatrice agissant via la dégradation simultanée d’un ensemble d’ARNm impliqués dans l’angiogenèse et l’inflammation.
L'appareillage IVIS d'imagerie de bioluminescence in vivo a été acquis par notre institut grâce à un cofinancement Inserm-CEA (Programme Technologies pour la Santé)